- քանի՞ միլիոն օրգանական նյութ է հայտնի մարդկությանը
Ավելի քան 186 մլն օրգանական նյութեր: - որո՞նք են օրգանական նյութերի բազմաթվության պատճառները
1-ին պատճառն այն է, որ օրգանական միացությունների հիմքը ածխածնի ատոմների շղթան է, որը տեսականորեն կարող է անսահման երկար լինել։
2-րդ պատճառն այն է, որ այս շղթան կարող է ունենալ այլ կառուցվածք (գծային, ճյուղավորված, ցիկլային)։
Եվ 3-րդ պատճառը՝ ածխածնի ատոմների միջև կարող են լինել տարբեր կապեր՝ պարզ, կրկնակի, եռակի։ Արդյունքում, իզոմերիզմն առաջանում է, երբ միևնույն բաղադրության նյութը գոյություն ունի բազմաթիվ իզոմերների տեսքով, որոնք ունեն տարբեր կառուցվածք, բայց տարբեր հատկություններ։ - ինչպիսի՞ քիմիական կապ է առկա օրգանական նյութերի մոլեկուլներում
Կովալենտային, իոնային, և մետաղական կապերը: - որո՞նք են կենսական տարրերը, ինչու՞ են են այդպես անվանում
Կենսական տարերը դա կենդանի օրգանիզմին աճելու, զարգանալու եւ բնականոն գործունեությունը պահպանելու համար անհրաժեշտ տարրեր են ։ Բոլոր օրգանիզմներին անհրաժեշտ է ածխածնի, ջրածին, թթվածին և ազոտ, որոնք իրենց են հասնում սննդի, օդի և ջրի հետ, քանի որ այդ էլեմենտներից է բաղկացած մարմնի հյուսվածքները: - ինչպիսի՞ օրգանական նյութեր են առաջացնում կենսական տարրերը
Մեր սնունդը պարունակում է ածխաջրեր, ճարպեր, սպիտակուցներ, հանքային աղեր և ջուր։ Այս բոլոր նյութերն անհրաժեշտ են մեր սնուցման համար։
Рубрика: Քիմիա 2021-2022
Օրգանական միացությունների առանձնահատկությունները
Ի տարբերություն անօրգանական նյութերի օրգանական նյութերն ունեն մի շարք բնորոշ առանձնահատկություններ։ Ամենից առաջ ածխածնի ատոմները ընդունակ են միանալու իրար հետ՝ առաջացնելով շղթաներ կամ օղակներ, որն այնքան էլ բնորոշ չէ անօրգանական միացություններին։ Դա օրգանական միացությունների բազմազանության պատճառներից մեկն է։
Օրգանական մոլեկուլներում ատոմների միջև կապը կովալենտային է։ Ուստի օրգանական նյութերը սովորաբար հանդիսանում են ոչ էլեկտրոլիտներ։
Եթե իոնային (անօրգանական) միացությունները հեշտությամբ ջրում դիսոցվում են իոնների և դրանց միջև ռեակցիաները ընթանում են շատ արագ, ապա պարզ (միակի) C-C և C-H կապեր պարունակող օրգանական նյութերը ռեակցում են իրար հետ մեծ դժվարությամբ կամ ընդհանրապես չեն փոխազդում։
Օրգանական միացությունները 400-600°С տաքացնելիս ամբողջապես քայքավում և ածխանում են, իսկ թթվածնի ներկայությամբ՝ այրվում։ Դա բացատրվում է ածխածնի ատոմների միջև կապերի համեմատաբար ոչ մեծ ամրությամբ (355,6 կջ/մոլ)։
Օրգանական միացությունների կարևոր առանձնահատկությունը հանդիսանում է այն, որ դրանց մոտ շատ տարածված է իզոմերիայի երևույթը։
Ածխածնի ատոմի առանձնահատկությունը բացատրվում է իր կառուցվածքով՝ այն ունի չորս արժեքական էլեկտրոններ։ Ածխածնի ատոմները այլ ատոմների, ինչպես նաև իրար հետ, առաջացնում են ընդհանուր էլեկտրոնային զույգեր։ Ընդ որում ածխածնի յուրաքանչյուր ատոմի արտաքին մակարդակում գտնվում են ութ էլեկտրոններ, որոնցից չորսը միաժամանակ պատկանում են այլ ատոմների։
Օրգանական քիմիայում սովորաբար օգտվում են կառուցվածքային բանաձևերից, քանի որ մոլեկուլում ատոմներն ունեն տարածական դասավորություն։ Կառուցվածքային բանաձևերը օրգանական քիմիայի լեզուն է։
Կառուցվածքային բանաձևերում կովալենտային կապը նշվում է գծիկով։ Ինչպես և անօրգական միացությունների կառուցվածքային բանաձևերում, յուրաքանչյուր գծիկ նշանակումէ ընդհանուր էլեկտրոնային զույգը, որով ատոմները կապված են մոլեկուլներում։ Օգտագործվում են նաև փորձային և էլեկտրոնային բանաձևեր։ Պատկերենք էթիլենի և ացետիլենի համար համապատասխան բանաձևերը.
Մետաղների ընդհանուր բնութագրումը` ֆիզիկական և քիմիական հատկությունները
«Մետաղ» բառը ծագել է հունական մետալոն արմատից, որը նշանակում է «հանք»:Պայմանականորեն, մետաղները ոչ մետաղներից բաժանող սահմանագիծը` բորը աստատին միացնող գիծն է պարբերական համակարգում: Մետաղները դասավորված են այդ գծից ձախ և ներքև, իսկ գծին մոտ տարրերը երկակի բնույթ ունեն:
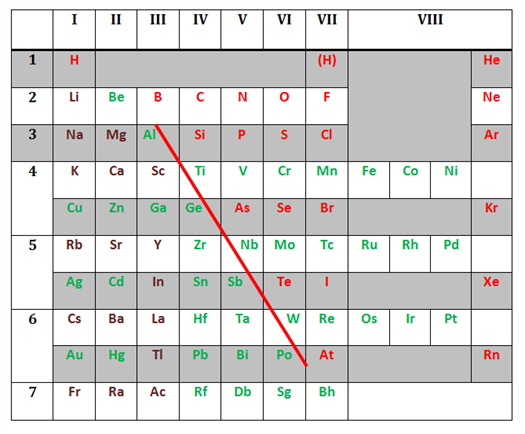
Քիմիական տարրերի դասակարգումը մետաղների և ոչ մետաղների պայմանական է: Օրինակ, բերիլիում (Be), ալյումին (Al) և ցինկ (Zn) տարրերը մետաղներ են, բայց դրանց առաջացրած օքսիդներն ու հիդրօքսիդներն օժտված են և՛ թթվային, և՛ հիմնային հատկություններով:
Իսկ ծարիր (Sb) և գերմանիում (Ge) տարրերն իրենց հատկություններով ավելի մոտ են ոչ մետաղներին: Իսկ օրինակ, սիլիցիումը (Si), արսենը (As) և աստատը (At) ցուցաբերում են որոշ մետաղական հատկություններ:
Մետաղները քիմիական ռեակցիաներում միայն վերականգնիչներ են, ինչն էլ մետաղները և ոչ մետաղները տարբերակող առանձնահատկություն է:
Մետաղների ատոմների չափերը (շառավիղները) համեմատաբար մեծ են, ուստի դրանց արտաքին էներգիական մակարդակի էլեկտրոնները զգալիորեն հեռու են միջուկից ու վերջինիս հետ թույլ են կապված:
Մետաղների ճնշող մեծամասնությունը ատոմների արտաքին էներգիական մակարդակում ունի 1-3 էլեկտրոն:
Մետաղների ֆիզիկական հատկությունները
Մետաղային բյուրեղավանդակի հանգույցներում կանոնավոր տեղաբաշխված են մետաղի կատիոններ ու ատոմներ, որոնք միմյանց հետ կապված են այդ կատիոններին համապատասխան վալենտային էլեկտրոնների բազմակի վրածածկից առաջացած ընդհանուր էլեկտրոնային ամպով:
Մետաղի դրական իոնների և ընդհանուր էլեկտրոնային ամպի փոխազդեցությամբ պայմանավորված կապն էլ անվանում են մետաղական:
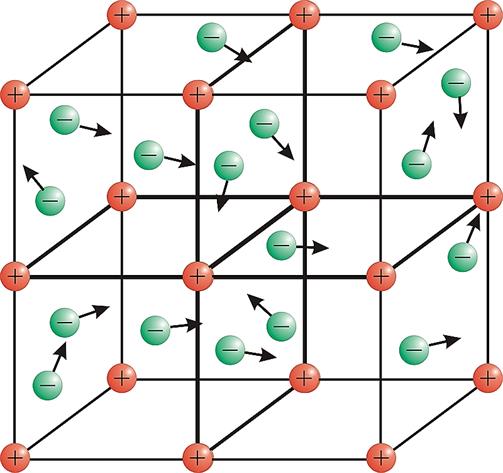
Բյուրեղավանդակի յուրահատուկ կառուցվածքը պայմանավորում է մետաղների կարևոր բոլոր ֆիզիկական հատկությունները՝ գույնը, կարծրությունը, հալման ջերմաստիճանը, խտությունը, էլեկտրահաղորդականությունը և ջերմահաղորդականությունը, մետաղական փայլն ու անթափանցիկությունը, պլաստիկությունը:
Մետաղները տարբեր գույնի են: Արտադրության ոլորտում դրանք պայմանականորեն բաժանվում են սև (երկաթն ու իր համաձուլվածքները) և գունավոր մետաղների (բոլոր մյուս մետաղները):
Սովորական պայմաններում բոլոր մետաղներին (սնդիկից բացի) հատուկ է պինդ ագրեգատային վիճակը, սակայն դրանց կարծրություններն ու հալման ջերմաստիճանները տարբեր են:
Ըստ խտության՝ մետաղները լինում են թեթև (ρ<5 գ/սմ³) և ծանր (ρ>5 գ/սմ³):
Ամենածանր մետաղն օսմիումն է՝ Os (ρ=22,6 գ/սմ³), իսկ ամենաթեթևը՝ լիթիումը՝ Li (ρ=0,53 գ/սմ³):
Մետաղները ջերմության և էլեկտրականության լավ հաղորդիչներ են:
Մետաղներից լավագույն հաղորդիչներ են համարվում արծաթը՝ Ag, պղինձը՝ Cu, ոսկին՝ Au, իսկ ամենավատը` կապարը՝ Pb, մանգանը՝ Mn և սնդիկը՝ Hg:
Հարթ մակերեսներով մետաղների փայլը պայմանավորված է լուսային ճառագայթների անդրադարձմամբ:
Արտաքին ազդակների ներգործությամբ մետաղները փոխում են իրենց ձևն ու պահպանում ընդունած ձևն այդ ազդեցությունը վերացնելիս: Դա պայմանավորված է այն հանգամանքով, որ արտաքին ազդեցության ներքո իոն-ատոմների մի շերտը մյուսի նկատմամբ սահում է՝ պահպանելով մետաղական կապը:
Երկաթ

Երկաթ, քիմիական նշանը՝ Fe:Երկաթը d-տարր է, պարբերական համակարգի ութերորդ խմբի երկրորդական ենթախմբում է, ատոմային համարը՝ 26։ Այն սպիտակ-արծաթափայլ մետաղ է։ Ատոմի էլեկտրոնային բանաձևն է 1s22s22p63s23p63d64s2։ Բացի Էներգիական չորրորդ մակարդակի 2 էլեկտրոնից, քիմիական կապերի առաջացմանը կարող են մասնակցել նաև երրորդ մակարդակի d-էլեկտրոնները։ Երկաթին բնորոշ են գերազանցապես +2 և +3 օքսիդացման աստիճանները։ Սակայն կան շատ քիչ թվով խիստ անկայուն միացություններ, որոնցում դրսևորվում է +6 օքսիդացման աստիճան։ Բնության մեջ տարածվածությամբ (4,65%) զբաղեցնում է չորրորդն է՝ թթվածնից(O), սիլիցիումից (Si) և ալյումինից (Al[1]).) հետո։ Ազատ վիճակում երբեմն հանդիպում է միայն որոշ երկաթաքարերի տեսքով։ Գտնվում է հիմնականում օքսիդային հանքաքարերում, որոնցից կարևորներն են գորշ երկաթաքարը (լիմոնիտ)(Fe2O3 . nH2O), կարմիր երկաթաքարը (հեմատիտ)(Fe2O3), մագնիսական երկաթաքարը (մագնետիտ) (Fe3O4), սիդերիտը (FeCO3), պիրիտ (հրաքար)՝ FeS2 և այլն։ Մարդու օրգանիզմում կա ~ 3գ երկաթ տարր գերազանցապես հեմոգլոբինի բաղադրության մեջ։
Երկաթի ստացում
Արդյունաբերությունում երկաթը ստանում են երկաթի հանքաքարից հիմնականում հեմատիտից (Fe2O3) և մագնիտից (FeO·Fe2O3)։ Գոյություն ունեն տարբեր որակական եղանակներ երկաթը հանքաքարից ստանալու համար։ Առավել տարածված եղանակներից է, երբ երկաթը ստանում են բացառապես հրամետաղարտադրական եղանակով՝ դոմնային վառարանում։
Ֆիզիկական հատկություններ
Երկաթը արծաթափայլ, սպիտակ, պինդ մետաղ է, խտությունը 7,87 գ/սմ3 է, հալման ջերմաստիճանը՝ 1539 °C։ Շնորհիվ ատոմում առկա չզույգված շատ էլեկտրոնների՝ երկաթն ունի պարամագնիսական հատկություն. ձգվում է մագնիսի կողմից։ Այդ մետաղին բնորոշ են արագ մագնիսանալու և ապամագնիսանալու հատկությունները, ինչը հնարավորություն է տալիս երկաթը լայնորեն օգտագործելու էլեկտրատեխնիկայում և էլեկտրոնային սարքերում։ Չափազանց մաքուր երկաթը բավականին կայուն է օդի թթվածնի նկատմամբ, սակայն սովորական մետաղը (խառնուկներ պարունակող) օդում աստիճանաբար ենթարկվում է կերամշակման, մանավանդ խոնավության առկայությամբ.
Փորձ
հարցեր և վարժություններ
Նախագծի բովանդակությունը * 5֊րդ խմբի գլխավոր. ենթախմբի տարրերի ընդհանուր բնութագիրը։
*Ազոտ և ֆոսֆոր տարրերի ատոմների կառուցվածքը։
Ազոտ
Ազոտը քիմիական տարր է, պարբերական աղյուսակի 5-րդ խմբի 7–րդ տարրը, քիմիական նշանը N, ատոմային թիվը 7, ատոմային զանգվածը՝ 14.0067: Էլեկտրոնային մակերեսի կարգը՝ 2s²2p³:
Ֆոսֆոր
Ֆոսֆորը քիմիական տարր է, որի նշանն է P։ Գտնվում է տարրերի պարբերական համակարգի 3-րդ պարբերության 5-րդ խմբի տարր։ Կարգահամարը 15, ատոմական զանգվածը 30,97376։ p տարր է, ատոմի արտաքին էլեկտրոնային թաղանթների կառուցվածքն է 3s2Зр3, К և Լ թաղանթները լրացված են։ Բնական ֆոսֆորը բաղկացած է միայն 31Р կայուն իզոտոպից։
*Ազոտ. ազոտի օքսիդները. ազոտական թթուն և նրա աղերը։
*Ֆոսֆորի պարզ նյութերը` կարմիր և սպիտակ ֆոսֆոր։ Օրթոֆոսֆորական թթուն և նրա աղեը։
* Ազոտական և ֆոսֆորական պարարտանյութեր։
Առողջ ապրելակերպ
1. Ֆիզիկական: Ֆիզիկական աշխատանքի արդյունքում ստեղծվում են նյութական բարիքներ՝ իրեր, առարկաներ, գործիքներ, հարմարանքներ:
2. Մտավոր: Մտավորի արդյունքում ստեղծվում են ոչ նյութական ժառանգության մասնիկներ` նոր գիտելիքներ, արվեստի գործեր, հոգևոր ու մշակութային արժեքներ:
Մարդու կենսագործունեության էական առանձնահատկություն է միջավայրը փոփոխելու նրա հակումն ու ընդունակությունը:
Կյանքի ընթացքում մարդը ակտիվ փոխազդում է իր միջավայրի հետ: Այդ ընթացքում նա շրջակա միջավայրը հարմարեցնում է իր կարիքներն ու պահանջները հոգալու համար:
Մարդը նպատակաուղղված ազդում է իր շրջակայի վրա այն իրեն ավելի բարենպաստ դարձնելու համար:
Օրինակ
Կառուցում է բնակարաններ, ջեռուցում, լուսավորություն, տեղափոխվում տրանսպորտով և այլն:
Մարդու ապրելակերպի ձևավորման վրա ազդում են միջավայրի երեք խումբ գործոններ`
- օգտակար գործոններ
- վնասակար գործոններ
- և՛ օգտակար, և՛ վնասակար գործոններ
Օգտակար գործոններն այն գործոններն են, որոնք կարևոր են մարդու ինքնազգացողության համար:
Օրինակ` թթվածնով հարուստ և մաքուր օդը, չափավոր, սննդարար և լիարժեք սնունդը, աշխատանքի բարենպաստ պայմանները, անաղմուկ միջավայրը և այլն:
Վնասակար գործոններ են մարդու ինքնազգացողությունն ու աշխատունակությունը խաթարող երևույթները:
Օրինակ` հիվանդածին բակտերիաները կամ վիրուսները, թունավոր սնկերը, տարբեր թունավոր նյութերը, փոշին, աղմուկը, աղտոտված օդը, որոնք անբարենպաստ պայմաններ են ստեղծում մարդու կենսագործունեության համար:
Ե՛վ օգտակար, և՛ վնասակար գործոնները այն հանգամանքներն են, որոնք կարող են ինչպես խաթարել, այնպես էլ բարելավել մարդու առօրյան:
Օրինակ` արևի ճառագայթները:
Մարդու առօրյայի և կենսագործունեության վրա ազդող գործոնների համալիր ուսումնասիրությամբ զբաղվում է հիգիենա գիտությունը:
Երբ այս գործոնները հավասարակշռված են` վնասակարները չեզոքացված, իսկ օգտակարները՝ ամրապնդված, ապա մարդն առողջ է:
Առողջությունը մարդու հիվանդությունների և ֆիզիկական արատների բացակայությունն է, ֆիզիկական և հոգեկան բարեկեցության ամբողջությունը:
Մարդու առողջությունը փխրուն է և կարող է խաթարվել, հետևաբար առողջությունը անհրաժեշտ է խնամել և ամրապնդել: Առողջությունն ամրապնդվում է որոշակի գործոններով:
Մարդու առօրյայի հետևողական կազմակերպումը սեփական առողջության պահպանման և կոփման նպատակով կոչվում է առողջ ապրելակերպ:
Առողջ ապրելակերպը ենթադրում է առողջությունն ամրապնդող որոշակի գործոնների անընդհատ ներգրործություն մարդու օրգանիզմի վրա:
Այդ գործոններն են`
Օրվա կանոնավոր ռեժիմը. ճիշտ ժամանակին և պարբերաբար սնվելու, սովորելու, աշխատանքի և հանգստի զուգորդումը, հանգստի և քնի ճիշտ համամասնությունը և այլն:
Մարդու օրվա ռեժիմը պետք է կառուցվի տարիքից կախված: Դպրոցահասակ երեխաների քնելու ժամը տարբերվում է մեծահասակների քնելու ժամից:
Ուշադրություն
Մարդը պետք է ամեն օր արթնանա առավոտյան նույն ժամին, կատարի ֆիզիկական ոչ բարդ մարզանք, լավ լվացվի, մաքրի ատամները, նախաճաշի և հետո շարունակի իր օրը:
Ցանկացած բնույթի աշխատանք` լինի դա ուսում, թե խաղ, թե մարմնամարզություն, ունի իր կանոնները, որոնք պետք է պահպանել.Օրգանիզմի մաքրությունը. մարդու մարմնի խնամքը, մաշկի և բերանի խոռոչի մաքուր լինելը, օրգանիզմի կոփումը, ճիշտ հագուստը:
Այդ ամենը ևս նպաստում են մարդու բնականոն զարգացմանը, բարձրացնում աշխատունակությունը, ինքնազգացողությունը, կատարելագործում մտածողությունը, նպաստում լիարժեք հանգստին:
Շարժողական բարձր ակտիվությունը. առավոտյան ֆիզիկական վարժությունները, չափավոր քայլքը, ֆիզիկական աշխատանքը, սպորտը առողջության ամրապնդման անհրաժեշտ գործոններ են:
Անընդհատ շփումը բնության հետ. զբոսանքները և շփումը բնության հետ նպաստում են մարդու առողջ կյանքին:
Մարդն իր կենսագործունեության ընթացքում ունենում է տարբեր դրսևորումներ` աշխատում է, սովորում, մտածում, ստեղծում: Այդ ամենը, երբ հաջորդում է իրար առանց դադարի` մարդը հոգնում է: Կարող է զարգանալ նաև գերհոգնածություն:
Հոգնածությունն օրգանիզմի բնականոն վիճակ է, որն ունի պաշտպանական դեր:
Տարբերում են մարդու երկու տիպի հոգնածություն`
ա. Ֆիզիկական հոգնածություն: Լարված ֆիզիկական աշխատանք կատարելիս մկանները հոգնում են և նվազում է դրանց աշխատունակությունը: Հոգնածության է հանգեցնում նաև միօրինակ աշխատանքը: Որոշակի ժամանակի ընթացքում հանգստից հետո մկանների աշխատունակությունը կրկին վերականգնվում է:
բ. Մտավոր հոգնածություն: Մտավոր գործունեությամբ լարված զբաղվելու հետևանքով թուլանում է ուշադրությունը, որն ընդմիջումից հետո ևս վերականգնվում է: Ընդմիջման ընթացքում կարելի է կատարել ֆիզիկական վարժություններ, դեմքը շփել սառը ջրով կամ անցնել այլ բնույթի գործունեության:
Երբ հանգիստը կամ ընդմիջումը բավարար չեն, զարգանում է գերհոգնածություն: Հոգնածությունը և գերհոգնածությունը խախտում են մարդու առողջությունը, հանգեցնում թուլության նաև՝ տարբեր հիվանդությունների զարգացմանը:
Աշխատանքի հիգիենան հոգնածության և գերհոգնածության կանխարգելման նպատակով մշակում է աշխատանքի կանոններ
1. Քնել պետք է 7-9 ժամ: Բայց կարելի է քնել նաև 5 կամ 6 ժամ, և դա կախված է նրանից, թե ինչպես է դրան արձագանքում մեր օրգանիզմը:
2. Սնունդ ընդունելիս՝
• Չի կարելի միանգամից ընդունել սնունդի շատ տարատեսակներ:
• Չի կարելի չափից ավելի ուտել (վերջում պետք է մի փոքր քաղց զգալ):
• Չի կարելի օգտագործել շաքարավազ, տորթ (կոնֆետ և շոկոլադ՝ երբեմն):
• Միրգ պետք է ուտել հիմնական սնունդ ընդունելուց առաջ (մոտ 30 րոպե), այլ ոչ թե՝ հետո:
• Սնունդ ընդունելուց 1-2 ժամ առաջ և հետո ջուր չխմել:
• Չուտել ժամը 19:00-ից հետո:
• Աշխատեք, որպեսզի Ձեր կերակուրի 60 տոկոսը լինի միրգ և բանջարեղեն:
• Աշխատեք շատ միս չօգտագործել:
• Օրական 2 բաժակից ավելի թեյ կամ սուրճ չխմել:
• Չօգտագործել քիմիա (չիպս, կոլա, գազավորված ըմպելիք և այլն):
• Չօգտագործել շատ ալկոհոլ, իսկ եթե կարող եք, ապա հրաժարվեք ընդհանրապես և ալկոհոլից, և ծխախոտից:
• Որքան հնարավոր է՝ քիչ օգտագործեք կոնսերվացված սնունդ:
3. Որքան հնարավոր է՝ շատ շարժվել, քայլել, և որքան հնարավոր է՝ քիչ նստել:
4. Ակտիվորեն զբաղվել սպորտով:
5. Միշտ պետք է հետևել կեցվածքին և՛ քայլելիս, և՛ նստելիս: Որովհետև ողնաշարի հետ կապված պրոբլեմները շատ վատն են:
6. Հետևել հիգիենային:
7. Էմոցիաներ: Աշխատեք որքան հնարավոր է շատ ուրախանալ կյանքով և որքան հնարավոր է քիչ նյարդայնանալ: Էմոցիաները շատ մեծ դեր են խաղում յուրաքանչյուր մարդու առողջության մեջ
Ֆոսֆորի պարզ նյութերը` կարմիր և սպիտակ ֆոսֆոր
Ֆոսֆոր քիմիական տարր, որի նշանն է P։ Գտնվում է տարրերի պարբերական համակարգի 3-րդ պարբերության 5-րդ խմբի տարր։ Կարգահամարը՝ 15, ատոմական զանգվածը՝ 30,97376։ p տարր է, ատոմի արտաքին էլեկտրոնային թաղանթների կառուցվածքն է՝ 3s2Зр3, К և Լ թաղանթները լրացված են։ Բնական ֆոսֆորը բաղկացած է միայն 31Р կայուն իզոտոպից։
Ֆիզիկական հատկություններ
Ֆոսֆորը բնության մեջ տարածված տարր է, կազմում է երկրակեղևի զանգվածի 9,3․10−2% (տարածվածությամբ 13-րդն է)։ Ֆոսֆորը բնորոշ հոտով, անգույն, մոմակերպ, թունավոր նյութ է, ստացվում է ֆոսֆորի գոլորշիները սառեցնելիս։
Հալման ջերմաստիճանը 44,1 °C, եռմանը՝ 280,5 °C, խտությունը՝ 1828 կգ/մ3։ Օդում (40 °C-ում) ինքնաբռնկվում է (պահում են ջրի տակ)։ Բաղկացած է Р4 մոլեկուլներից (Ֆոսֆորի մյուս ձևափոխություններն ատոմական պոլիմերներ են)։ Տաքացնելիս 250-300 °C դանդաղ փոխարկվում է կարմիր ֆոսֆորի։ Այն առաջացնում է բյուրեղական մի քանի ձևափոխություններ, որոնք 416-423 °C-ում սուբլիմվում են և ունեն 2000-2400 կգ/մ3 խտություն։
Քիմիապես ավելի պասսիվ է, օդում բռնկվում է 240-250 °C տաքացնելիս, համարյա թունավոր չէ։ Չի լուծվում ջրում և ծծմբածխածնում։ Ապրանքային կարմիր ֆոսֆորը գործնականորեն ամորֆ է, գույնը՝ կարմրաշագանակագույնից մանուշակագույն։
Սպիտակ ֆոսֆորը ճնշման տակ (մոտ 15 000 մթնոլորտ) տաքացնելիս՝ 200-220 °C, փոխարկվում է սև ֆոսֆորի (նման է գրաֆիտին, կիսահաղորդիչ է)։
Հեղուկ և գազային ֆոսֆորը բաղկացած է P4 մոլեկուլներից։ Ֆոսֆորը տիպիկ ոչ մետաղ է, քիմիապես ակտիվ է։ Միացություններում գերազանցապես ցուցաբերում է -3, +3 և +5 օքսիդացման աստիճաններ (արժեքականությունը 3 և 5, հազվադեպ 4, 1 և 4)։ Ոչ մետաղների հետ առաջացնում է կովալենտային կապ։ Առաջացնում է սահմանափակ թվով իոնական միացություններ (Na3P, Ca3P2 և այլն)։ Ֆոսֆորը վերականգնիչ է, օքսիդացնող հատկությունները շատ թույլ են արտահայտված։ Ֆոսֆորի երկու կարևոր ալոտրոպ ձևերն են՝ սպիտակ ֆոսֆորը և կարմիր ֆոսֆորը։ Սև ֆոսֆորն ստացվում է սպիտակ ֆոսֆորը բարձր (շուրջ 1200 մեգապասկալ) ճնշման տակ տաքացնելիս։
Քիմիա
Թթուները քիմիական նյութեր են, որոնց մոլեկուլները բաղկացած են մետաղների ատոմներով տեղակալվելու ընդունակ ջրածնի մեկ կամ մի քանի ատոմներից և թթվային մնացորդից: Թթուները ջրում առաջացնում են H+ իոններ: Այդ իոնների առկայությամբ էլ պայմանավորված են թթուների ջրային լուծույթների հատկությունները՝ թթու համը, քիմիական ինդիկատորների գույնը փոխելու ունակությունը և այլն: Ըստ մոլեկուլից պոկվող պրոտոնների թվի՝ թթուները լինում են միահիմն (HCl, HNO3, CH3COOH), երկհիմն (H2SO4, H2CO3), եռհիմն (H3PO4): Որքան մեծ է թթվի իոնների տրոհման` դիսոցման աստիճանը, այնքան այն ավելի ուժեղ է: Ըստ բաղադրության` թթուները լինում են թթվածնավոր (HNO3, H2SO4, H2CO3, H3PO4 և այլն) և անթթվածին (HCl, HBr, HF, H2S և այլն):
Այն բարդ նյութերը, որոնք կազմված են ջրածնի մեկ կամ մի քանի ատոմից և թթվային մնացորդից կոչվում են թթուներ:
Ըստ բաղադրության բաժանվում են երկու խմբի՝ անթթվածնավոր և թթվածնավոր:ԱնթթվածնավորԹթվածնավորHClHNO2HBrHNO3HJH2SO3H2SH2SO4HFH2CO3H2SiO3H3PO4
Ըստ հիմնայնության բաժանվում են երկու խմբի՝ միահիմն և երկհիմն կամ բազմահիմն:ՄիահիմնԲազմահիմնHClH2SHBrH2SO3HFH2SO4HJH2CO3HNO2H2SiO3HNO3H3PO4
Թթվային մնացորդի օքսիդային աստիճանը կախված է ջրածնի ատոմների թվից:ԱնունըԲանաձևըԹթվային մնացորդՖտորաջրածնական թթուHFF (ֆտորիդ)Քլորաջրածնական թթուHClCl (քլորիդ)Բրոմաջրածնական թթուHBrBr (բրոմիդ)Ծծմբաջրածնական թթուH2SS2 (սուլֆիդ)Յոդաջրածնական թթուHJI (յոդիդ)Ազոտական թթուHNO3NO3 (նիտրատ)Ազոտային թթուHNO2NO2 (նիտրիտ)Ծծմբային թթուH2SO3SO3 (սուլֆիտ)Ծծմբական թթուH2SO4SO4 (սուլֆատ)ածխաթթուH2CO3CO2 (կարբոնատ)
Քիմիա
Նախագծի բովանդակությունը.
*1. Ջրածինը բնության մեջ
*2. Ջրածնի ատոմի կառուցվածքը, իզոտոպները
*3. Ջրածնի ստացումը լաբորատորիայում և արդյունաբերության մեջ
*4. Ջրածնի ֆիզիկական և քիմիական հատկությունները
*5. Ջրածնի կիրառումը
Լաբորատոր փորձեր՝ <<Ջրածնի ստացումը>>, <<Թթուների քիմիական հատկությունները>>
Թեմատիկ հարցեր և վարժություններ.
1. Ինչո՞ւ է ջրածինը համարվում համար մեկ տարրը Տիեզերքում…
2. Ջրածինը համարվում է ապագայի վառելանյութ. ինչո՞ւ. …
3. Բնութագրեք ջրածին քիմիական տարրի իզոտոպները.
ա) քիմիական նշանը. ..
բ) հարաբերական ատոմային զանգվածը. ..
գ) մետա՞ղ է. թե՞ ոչ մետաղ.
դ) դիրքը պարբերական համակարգում.այսինքն ո՞ր պարբերության և ո՞ր խմբի տարր է
դ) ատոմի կառուցվածքը`(միջուկի լիցքը. ..միջուկում պրոտոների թիվը. ..էլեկտրոնների թիվը…էներգետիկ մակարդակների թիվը ),իզոտոպների բաղադրությունը
4. Ջրածնի վալենտականությունը և օքսիդացման աստիճանը միացություններում՝ գրեք պարզ և բարդ նյութերի օրինակներ և դրանցում որոշեք ջրածնի վալենտականությունը և օքսիդացման աստիճանը…..
5. Գրեք ջրածին քիմիական տարր պարունակող պարզ բարդ նյութերի բանաձևերը. և որոշեք նրանց հարաբերական մոլեկուլային զանգվածները ` Mr, մոլային զանգվածները`M գ/ մոլ, նաև բարդ նյութերի որակական և քանակական բաղադրությունները…
6. Որոշեք ջրածինը օդից ծանր է թե՞ թեթև. քանի ՞ անգամ. ..
7. Ինչպիսի ՞ ռեակցիաների օգնությամբ կարելի է լաբորատորիայում ջրածին ստանալ, գրեք համապատասխան ռեակցիաների հավասարումները. …
8. Ո՞րն է ջրածնի առաջացրած և Երկրագնդում ամենատարածված բարդ նյութը. գրեք այդ նյութի քիմիական բանաձևը և որոշեք ջրածնի զանգվածայլն բաժինը տոկոսով արտահայտած։
9. Որտե՞ղ են կիրառում ջրածինը….
Անհատական-հետազոտական աշխատանքների թեմաները՝
*1- <<Ջրածինը համարվում է ապագայի վառելանյութ. ինչո՞ւ. …>>
*2- <<Ո՞րն է համարվում մաքուր խմելու ջուր…>>
*3- <<Թթուներ>>
Աշխատանքում պիտի լինեն հետևյալ հարցերի պատասխանները.
*1. Սահմանել ո՞ր բարդ նյութերն են կոչվում թթուներ. ..
*2. Գրեք անթթվածին թթուների բանաձևերը և անվանումները…
*3. Գրեք թթվածնավոր թթուների բանաձևերը և անվանումները…
*4. Ինչպե՞ս են ստանում թթուներ…
*5. Թվարկեք թթուների ֆիզիկական հատկությունները…
*6. Գրեք թթուների քիմիական հատկությունները. այսինքն թթուների փոխազդեցությունը
պարզ և բարդ նյութերի հետ…
*7. Կենցաղում օգտագործվող ինչպիսի՞ թթուներ գիտեք…
Ջրածնի իզոտոկներն են Պրոտիում +1/1)/
Դելտերիյում +¹H² +²,D
Տրիտիում+¹H³ ³+¹T* ²+¹D(lp;In)’e